金沙8888js官方成都生物研究所功能生物大分子和生物检测学科组发展了一个全新的核酶细胞内分子间筛选策略:以一个毒性蛋白(IbsC)为报告基因,在大肠杆菌中通过核酶对其mRNA的剪切来调节毒蛋白的表达——如果核酶活性较低,IbsC可有效表达而导致细菌死亡;当核酶具有较高活性时,毒性蛋白的表达下降细菌则可以在筛选平板上生长出菌落(如图1A)。因此在锤头核酶的催化活性中心和突环处引入随机突变建立筛选文库(图1B),经过多轮筛选,通过基于毒蛋白的筛选策略成功获得多个锤头核酶突变克隆(图1C),随后通过测序获得了10个具有活性的锤头核酶突变体。
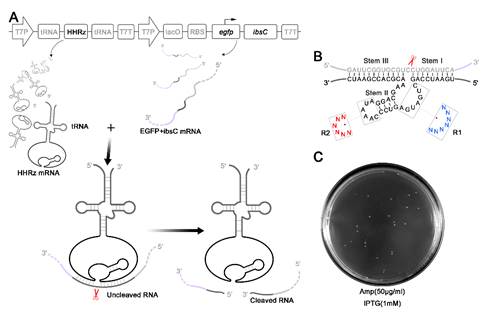
图1(A)核酶的细胞内筛选策略;(B)筛选库设计;(C)筛选结果。
由于基于毒蛋白的筛选体系难于定量分析筛选出来的核酶在细胞内的剪切效率,他们随后设计了一个基于双荧光蛋白的报告体系来定量对比不同核酶之间的剪切效率(图2A)。用红色荧光蛋白的基因替换毒蛋白基因作为报告基因,通过改变核酶的底物结合序列使得核酶靶向红色荧光蛋白的mRNA,同时融合表达了绿色荧光蛋白的基因作为内参,可以通过流式细胞仪检测细菌红色荧光相对绿色荧光的降低程度来评估核酶在细胞内的敲降效果。双荧光报告体系结果表明,筛选的核酶中有三个突变体(TX-2,TX-5,TX-9)比野生型核酶对细胞内的靶基因的敲降效果更好(图2B),其中TX-2对红色荧光的敲降效率是野生型核酶的2倍。为确定核酶对靶基因的剪切是否在不同的RNA序列上的通用性,他们又选择了红色荧光蛋白上另外两个位置进行剪切,TX-2在三个剪切位置对靶基因的敲降效果表现出了稳定一致的高效催化活性(图2C和D)。
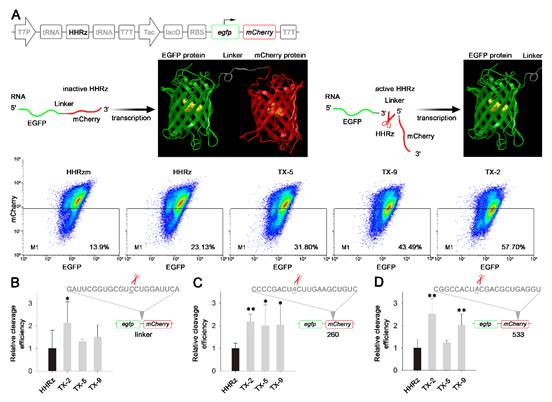
图2. 锤头核酶HHRz对大肠杆菌红色荧光蛋白基因的敲降
由于TX-2是在原核细胞中获得,随后考察了TX-2在真核细中的基因的敲降能力: 首先在癌细胞Hela中对比了筛选获得的核酶对红色荧光蛋白的敲降效率,结果表明TX-2的敲降效果显著好于野生型核酶;随后,以斑马鱼的体细胞色素沉着基因(nacre)为核酶的靶标,研究核酶在动物模型上对特定内源基因的敲降(图3)。结果表明,注射表达TX-2质粒的斑马鱼与野生型核酶注射的鱼相比,体细胞色素沉着明显减少,RT-PCR的结果也表明TX-2会引起nacre基因在RNA水平上显著减低(图3A)。又以斑马鱼的尾部发育基因(ntl)为靶标进一步验证TX-2的敲降效率,结果表明TX-2比野生型核酶具有更好的靶基因敲降效果(图3B),注射TX-2核酶导致超过27%的斑马鱼出现典型的无尾表型。这些结果说明TX-2可以作为一个有效的工具用于细胞内的基因敲降。
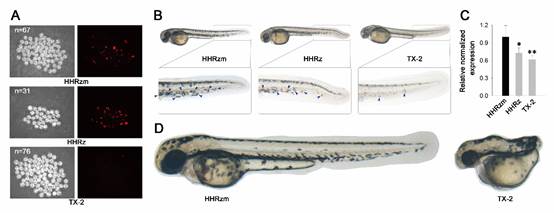
图3 (A)TX-2对斑马鱼红色荧光蛋白基因的敲降;(B)(C)TX-2对斑马鱼nacre基因(控制色素沉着)的敲降;(D)TX-2对斑马鱼ntl基因(控制尾部发育)的敲降
综上所述,通过体内筛选方法得到的核酶TX-2无论在原核还是在真核细胞内都表现出比野生型锤头核酶更好的基因敲降效果,说明基于毒蛋白的细胞内筛选体系完全适于催化分子间核酶工具的进化和筛选,同时通过体内筛选获得的活性大大增强的突变型锤头核酶,目前用腺相关病毒为载体利用,TX-2作为新的分子工具在癌症的基因治疗研究工作已经在该研究团队展开。
该研究的主体工作由金沙8888js官方成都生物所黄鑫博士完成,整个研究工作历时四年的时间,同时感谢四川大学生物治疗国家重点实验室的莫显明教授和赵永云博士对该研究工作的支持与帮助,该研究结果已发表在2019年 Nucleic Acids Research (IF: 11.561)上。
