智能化的可控释放纳米递药体系可以对诸如pH、温度、光照、氧化剂、酶以及超声辐照等外界的环境的刺激做出反馈性响应,以其优异的控制释放功能而在药物传输体系中表现出极具前景的潜在应用。其可针对肿瘤细胞与正常组织的生物学差异选择性释药,有效地降低了抗肿瘤药物对正常细胞的毒副作用,大大提高药物的利用率。但是,由于肿瘤组织及细胞的环境复杂性,单一的刺激模式或者简单的功能输出已经不能满足日新月异的聚合物材料的需求. 因此发展更新型的刺激条件、多元化的刺激方式和具有逻辑控制特点的功能响应已经成为构筑刺激响应性聚合物体系的难点与热点。
中科院成都生物所李帮经研究员课题组长期致力于基于环糊精主客体识别作用来构筑智能纳米递药系统。针对肿瘤细胞内存在的高浓度谷胱甘肽(GSH)及酸性环境特性,该课题组利用环糊精修饰的天然多糖透明质酸和金刚烷修饰的抗癌药物喜树碱(ADA-CPT),通过环糊精与金刚烷的特异性主客体识别作用,简单高效地构筑了一类双重肿瘤微环境刺激响应性的纳米递药体系。当纳米药物载体通过肿瘤组织的EPR作用富集在肿瘤组织中,并进一步被肿瘤细胞内吞后,肿瘤细胞内的酸性环境将环糊精与透明质酸相连的pH敏感的亚胺键破坏,释放出环糊精与金刚烷的包合物(β-CD/ ADA-CPT),并形成粒径更小的载药纳米体;同时,在高浓度的GSH环境存在下,ADA-CPT分子中的双硫键结构破坏,并进一步释放出抗癌药物CPT,实现对肿瘤细胞的杀灭作用,如图1所示。通过利用肿瘤细胞内的酸性环境及高浓度GSH环境,该双重刺激响应性的纳米递药体系还可以实现抗癌药物的分步按需释放,提供更为灵巧的控制释放性能。
相关文章发表在期刊Polymer Chemistry 上,(pH, glutathione dual-triggered supramolecular assemblies as synergistic and controlled drug release carrier. Polymer Chemistry, 2017, DOI: 10.1039/C7PY01644A)。论文的第一作者为中科院成都生物所助理研究员康洋。
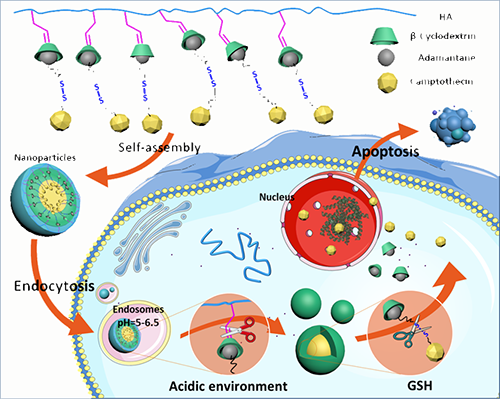
图一.pH, GSH双重刺激响应性纳米药物载体的自组装及肿瘤细胞内释药示意图。
