刺激响应性聚合物胶束可以对诸如pH、温度、光照、氧化剂、酶以及超声辐照等外界的环境的刺激做出反馈性响应,以其优异的控制释放功能而在药物传输体系中表现出极具前景的潜在应用。其可针对肿瘤细胞与正常组织的生物学差异选择性释药,有效地降低了抗肿瘤药物对正常细胞的毒副作用,大大提高药物的利用率。但是,由于肿瘤组织及细胞的环境复杂性,传统的刺激响应性聚合物往往由于响应性单一,不能实时调控等缺陷,限制了其进一步的发展与应用。
金沙8888js官方成都生物研究所李帮经研究员课题组长期致力于基于环糊精主客体识别作用应用于纳米药物载体的构筑。针对肿瘤细胞内存在的高浓度谷胱甘肽(GSH)及高活性氧(ROS)特性,该课题组利用环糊精修饰的聚乙二醇(mPEG-β-CD)和二茂铁修饰的抗癌药物喜树碱(Fc-CPT),通过环糊精与二茂铁的主客体识别作用,简单高效地构筑了两亲性的超分子前药mPEG-β-CD/Fc-CPT,该超分子前药可以进一步在水中自组装形成粒径均一的纳米胶束。当胶束通过EPR作用富集在肿瘤组织中,并进一步被肿瘤细胞内吞后,肿瘤内的高浓度ROS可引起环糊精与二茂铁分子的主客体识别作用破坏,导致胶束的瓦解;同时,在富含GSH的环境存在下,Fc-CPT分子中的二硫键结构破坏,并进一步释放出抗癌药物CPT,实现对肿瘤细胞的杀灭作用。同时他们还发现,单独的Fc-CPT分子也具有较好的抗癌活性,通过利用肿瘤细胞内的高浓度ROS和GSH环境,该氧化还原双重响应的超分子前药胶束还可以实现抗癌药物的分步按需释放,提供更为灵巧的控制释放性能。
相关文章发表在美国化学会期刊ACS Applied Materials & Interfaces 上。
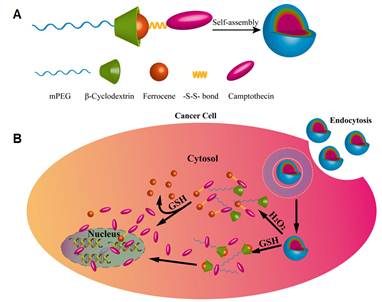
超分子前药mPEG-β-CD/Fc-CPT的自组装及肿瘤细胞内释药示意图
