刺激响应性聚合物胶束可以对诸如pH、温度、光照、氧化剂、酶以及超声辐照等外界的环境的刺激做出反馈性响应,已被广泛应用于药物载体、传感器、纳米器械等诸多领域。但是,传统的刺激响应性聚合物具有响应性单一、不能实时调控等缺陷,限制了其进一步的发展与应用。
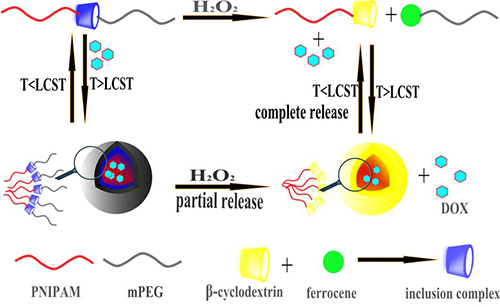
金沙8888js官方成都生物研究所李帮经研究员长期致力于基于环糊精主客体识别的自组装生物医药材料研究,针对传统的刺激响应性聚合物胶束的缺陷,借鉴均聚物正交自组装的方法,利用环糊精与二茂铁的可逆性主-客体识别作用将二茂铁修饰的聚乙二醇单甲醚与β-环糊精修饰的N-异丙基丙烯酰胺通过可逆的非共价键链接来构筑超分子嵌段共聚物mPEG-Fc/ PNIPAM-β-CD,并研究其氧化剂和温度的双重环境刺激响应性行为。在水溶液中,当温度高于PNIPAM的临界转变浓度时,完全亲水的超分子嵌段共聚物mPEG-Fc/ PNIPAM-β-CD将会变为两亲性分子,并进一步在水中自组装为胶束结构进行药物的包裹(如图所示)。当加入双氧水作为氧化剂时,由于双氧水二茂铁氧化为带正电的离子态Fc+,Fc+不能与环糊精产生包合,使得原有的包合结构瓦解,并伴随着药物的部分释放,超分子嵌段共聚物变为mPEG-Fc+和PNIPAM-β-CD。而由于此时温度仍然在PNIPAM的LCST之上,PNIPAM-β-CD可以二次组装形成以PNIPAM链段为疏水性内核,以β-CD为亲水性外壳的次级胶束结构,并将部分药物包裹在此次级胶束结构之中。当进一步降低体系的温度至PNIPAM的LCST之下时,PNIPAM链段完全变为亲水,使得次级胶束结构瓦解,伴随着药物的完全释放。该胶束体系具有释放可控的优良特性,可以利用肿瘤细胞内的高浓度的H2O2环境与简单的冰敷降温或冷冻探针方法,实现药物的定量释放。
相关文章发表在国际权威杂志ACS Macro Letters上。
制备流程
